初中化学的重中之重,难点中的一部分——酸碱盐。
简单做下酸碱盐知识点的归纳。
首先来总结一下这部分的知识点。
溶液的酸碱性
一、酸性溶液和碱性溶液
1.酸性溶液、碱性溶液和指示剂的反应:
实验试样白醋酸果汁稀盐酸纯碱溶液肥皂水石灰水氨水食盐水蔗糖水滴加紫色石蕊试液变红变红变红变蓝变蓝变蓝变蓝紫色紫色滴加无色酚酞试液无色无色无色变红变红变红变红无色无色结论酸性酸性酸性碱性碱性碱性碱性中性中性结论:
(1)凡是能使紫色石蕊试液变红的溶液都是酸性溶液,且该溶液不能使无色酚酞试液变色;
(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;
(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液;
(4)紫色石蕊试液和酚酞能检验溶液酸碱性的试剂,我们称为酸碱指示剂。
注意:
①酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;
②只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质,而且这酸碱和指示剂的反应属于化学变化。
2.日常生活中常见的酸性物质与碱性物质
(1)酸性物质:山楂、柠檬、柑橘、西红柿,食醋等;
(2)碱性物质:熟石灰,碳酸钠等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液
注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵,硫酸氢钠的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.酸、碱、盐的概念
(1)酸:电离时生成的阳离子全部是氢离子的化合物。如:HCl、HNO3、H2SO4、H2CO3等。
HCl= H+ + Cl-(一元酸);H2SO4= 2H++SO42-(二元酸);
(2)碱:电离时生成的阴离子全部是氢氧根离子的化合物。如:NaOH、Ca(OH)2等。
NaOH = Na+ + OH-(一元碱);Ca(OH)2 = Ca2+ + 2OH-(二元碱);
(3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。如:NaCl、NH4NO3等。
NaCl = Na+ + Cl-; NH4NO3 = NH4+ + NO3-;
二、溶液的酸碱性的强弱
1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。

酸性增强 中性 碱性增强
溶液的pH值与酸碱性关系:
pH=7,溶液呈中性;
pH<7,溶液呈酸性,且pH越小,酸性越强;
pH>7,溶液呈碱性,且pH越大,碱性越强。
3.pH试纸的使用方法:
用玻璃棒蘸取待测溶液,滴在PH试纸上,显色后对照标准比色卡,读出读数。
注意:
(1)不能直接把pH试纸浸入待测溶液中;
(2)不能先用水将pH试纸润湿,再进行测试,因为水润湿后的pH试纸再滴入待测液相当于被稀释;
(3)实验室使用的pH试纸是广泛pH试纸,测出的pH值是1~14的整数;
三、溶液酸碱性与生命活动的关系
1.人的体液有一定的酸碱度。血液、组织间液和细胞内液的酸碱度都接近于中性,而且变化极小;
2.胃液的pH在0.9~1.5之间,胃液的主要成分是盐酸HCl;
3.大多数农作物适宜在接近中性(pH在6.5~7.5之间)的土壤中生长,在改良酸性土壤时,我们一般是使用熟石灰来调节其酸碱度;
4.雨水一般呈略酸性(由于空气中的二氧化碳溶解在雨水中),正常雨水的PH≈5.6,人们一般把pH小于5.6 的雨水称为酸雨。
■常见的酸和碱
一、常见的酸
1.生活中常用的酸:胃液中含有的盐酸(HCl),蓄电池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH);饮料中可能含有的碳酸、柠檬酸等。
2.浓硫酸、浓盐酸和浓硝酸的物理性质
浓硫酸浓盐酸浓硝酸溶质的化学式H2SO4HClHNO3颜色无色无色无色状态粘稠、油状液体液体液体气味无味刺激性气味刺激性气味浓度98%36%~37%70%密度(与水比较)1.84g/mL1.17g/mL1.42g/mL敞开试剂瓶口发生的现象无明显现象产生白雾产生白雾是否具有挥发性不易挥发有挥发性有挥发性与水混合放出大量的热无明显放热无明显放热露置在空气中后的溶液质量变大变小变小露置在空气中后的溶质质量不变变小变小露置在空气中后的溶剂质量变大不变不变露置在空气中后的质量分数变小变小变小注意:浓硫酸具有一定的特性:
(1)吸水性(物理性质)用于气体干燥,但除NH3等碱性气体除外,对应的化学方程式为:2NH3 + H2SO4 ==(NH4)2SO4;
(2)脱水性(化学性质)—浓硫酸与蔗糖反应,使之炭化;
(3)强氧化性,腐蚀性——与金属发生反应,生成的气体不生成氢气而是二氧化硫。
在信息题目中个,有时候我们会遇到这样的题目:在加热的条件下,能与排在氢后面的金属(如Cu)反应,如:
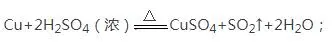
(4)浓硫酸的稀释:酸入水,沿器壁,搅拌。
浓硫酸溶于水放出大量的热,可以使水分沸腾。如果把水倒入浓硫酸中,水就会浮在浓硫酸上面,溶解时放出大量的热致使水沸腾而使硫酸液滴向四周飞溅。
(5)安全事故处理:浓硫酸溅到皮肤上后,首先迅速用抹布将其擦拭,然后用大量水冲洗,最后用3%~5%的NaHCO3涂敷。
4.酸的化学性质
(1)实验:稀硫酸、稀盐酸、稀硝酸化学性质的比较
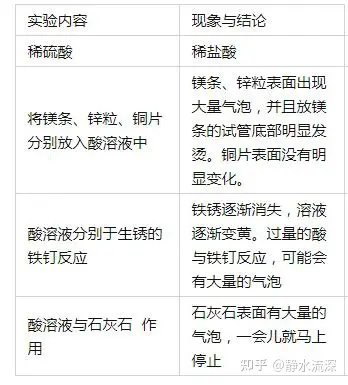
总结:
酸所具有的共同特点:(酸在水溶液中都能电离出氢离子,故酸溶液会具有许多共同的性质。)
二、酸的通性(5条):
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
(2)酸+金属=盐+氢气(置换反应)
酸溶液 + (氢前)金属 → 盐溶液 + 氢气
注意:
A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放
热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应,如:
Zn + 2HCl = ZnCl2 + H2↑;
Fe + H2SO4 = FeSO4 + H2↑ .
(3)酸+金属氧化物=盐+水(金属氧化物又称碱性氧化物,属于复分解反应)
该反应过程中,金属元素的化合价不变,酸中的原子团不变, 如:
CuO + 2HCl = CuCl2 + H2O;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;
ZnO + 2HNO3 == Zn(NO3)2+H2O;
在一些资料以及考试题目当中,也有先关的知识,可以提前了解:
酸性氧化物碱性氧化物定义凡能与碱反应生成盐和水的氧化物大多数非金属氧化物是酸性氧化物大多数酸性氧化物是非金属氧化物。凡能与酸反应生成盐和水的氧化物大多数金属氧化物是碱性氧化物所有碱性氧化物是金属氧化物。化学性质大多数可与水反应生成酸:CO2+H2O= H2CO3;
SO2+H2O= H2SO3;
SO3+H2O= H2SO4.少数可与水反应生成碱:Na2O+H2O=2NaOH;K2O+H2O=2KOH;BaO+H2O=Ba(OH)2;CaO+H2O==Ca(OH)2.酸性氧化物+碱→盐+水CO2+Ca(OH)2=CaCO3↓+H2O (不是复分解反应)碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2O(是复分解反应)(4) 酸 + 碱= 盐 + 水(又称为中和反应,反应类型:复分解反应)
注意:有盐和水的生成不一定是中和反应,如CO2+Ca(OH)2=CaCO3↓+H2O ;
(5)酸+盐=新酸+新盐
注意:
A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸 + 碳酸盐 =新盐 + 水 + 二氧化碳,依然是复分解反应;
如:
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑;
Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑;
K2CO3 + 2HNO3 =2KNO3 + H2O + CO2↑;
MgCO3 + 2CH3COOH = (CH3COO)2Mg + H2O + CO2↑;
B.某些特殊的盐能与酸反应,生成特殊的沉淀,需要记忆沉淀
如:
HCl + AgNO3 == AgCl↓+ HNO3 ;
BaCl2 + H2SO4 == BaSO4↓+ 2HCl.
补充: Cl-及SO42-的检验
A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-;
B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。
三、常见的碱
实验内容实验现象氢氧化钠、氢氧化钙、氨水 物理性质的比较名称氢氧化钠氢氧化钙氨水化学式NaOHCa(OH)2NH3•H2O颜色白色白色无色状态片状固体粉末状固体液体气味无味无味有氨臭气味溶解性易溶微溶易溶俗称烧碱、火碱苛性钠熟石灰消石灰——氢氧化钠、氨水 露置在空气中发生的变化固体氢氧化钠露置在空气中,表面出现潮湿,这个现象称为潮解。同时氢氧化钠也会吸收空气中的二氧化碳而质变,生成碳酸钠。氨水露置在空气中,会使其溶质质量分数变小。烧碱在水中的溶解情况放出大量的热,水溶液具有滑腻感。在硫酸铜溶液中滴加石灰水出现蓝色沉淀CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4↓1.有关碱的一些性质比较
烧碱具有强腐蚀性,氢氧化钙和氨水也具有一定的腐蚀性。
2.碱的共同性质(由于碱电离后都能生成OH-,因此也具有相同的性质)
四、碱的四大通性:
首先了解,碱的电离,如:
NaOH = Na+ + OH-;
NH3•H2O = NH4+ + OH-(NH3溶于水,滴加酚酞变红的原因);
(1)与酸碱指示剂作用
A.紫色石蕊试剂遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红。
(2)碱溶液 + 非金属氧化物 → 盐 + 水(非金属氧化物又称酸性氧化物,该反应不是复分解反应)
如:
2NaOH + CO2 = Na2CO3 + H2O;
Ca(OH)2 + SO2 = CaSO3↓ + H2O;
(3)碱 + 酸 = 盐 + 水
(4)碱 + 盐 = 新盐 + 新碱
如:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓;
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(工业制碱法,纯碱制烧碱);
3.复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。
反应表达式:AB + CD =AD + CB 表示。
特点:(两两交换,价态不变)
(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
注:难溶性碱受热易分解(不属于碱的通性)
■ 几种重要的盐
一、盐
1.盐的分类:依据组成盐的阳离子和酸根的种类进行分类
根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐)
根据酸根的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐)
2.酸、碱、盐的溶解性规律:
①酸都溶;②溶碱有五位:钾、钠、铵、钙、钡;③钾盐、钠盐、铵盐、硝酸盐都可溶;④盐酸盐只有氯化银不可溶;⑤硫酸盐只有硫酸钡不可溶;⑥碳酸盐只溶钾、钠、铵,剩下都不溶。
注意:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸。
10种常见沉淀:
AgCl↓、BaSO4↓:不和酸反应;
以下的沉淀都和酸反应:
Cu(OH)2↓:蓝色沉淀;
F e(OH)3↓:红褐色沉淀;
其余的沉淀都是白色:
BaCO3↓、CaCO3↓:和酸反应,产生气体,气体能使澄清石灰水变浑浊;
Zn(OH)2↓、Mg(OH)2↓、Fe(OH)2↓、Al(OH)3;
3.盐的化学性质:
(1)盐 + 金属 =新盐 + 新金属(置换反应)
在金属活动性顺序表中,除非常活泼的金属K、Ca、Na之外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中置换出来,如:
Zn + CuSO4 = ZnSO4 + Cu;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2;
(2)盐+碱 = 新盐+新碱
如:
CuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO4;(CuSO4 和 Ca(OH)2 配置农药波尔多液)
(3)盐+酸 = 新盐+新酸
Na2CO3+2HCl ==2NaCl+H2O+CO2↑
■判断复分解反应发生的条件:
a.有沉淀生成;
b.有气体放出;
c.有水生成;
d.如果是没有酸参加的反应,则两种反应物必须都溶于水。
二、几种常见的盐
1.氯化钠(NaCl)
厨房中常见的调味剂;生理盐水的成分;农业上用来选种;做冰雪消融剂。
2.碳酸钠(Na2CO3)
(1)俗名:纯碱、苏打
(2)纯碱不是碱,是盐(水溶液显碱性)
(3)用途:玻璃、造纸、纺织和洗涤剂的生产等
(4)Na2CO3+ 2HCl =2NaCl + CO2↑+ H2O(灭火器的原理)
3.碳酸氢钠(NaHCO3)
(1)俗名:小苏打
(2)用途:焙制糕点;发酵粉的主要成分、治疗胃酸过多;
(3)NaHCO3+ HCl =NaCl + CO2↑+ H2O .
4.碳酸钙(CaCO3)
(1)大理石、石灰石、钟乳石、贝壳、珍珠、蛋壳、锅炉和水壶的水垢的主要成分
(2)用途:建筑材料、补钙剂
(3)CaCO3+2HCl===CaCl2+ CO2↑+ H2O;
(4)相对分子质量为100,Ca元素的质量分数占40%.
补充:碳酸盐(CO32-、HCO3- )的检验:
A.向待测溶液中加入稀HCl后有气泡生成,将产生的气体通入澄清石灰水,若澄清石灰
水变浑浊,则溶液中含有CO32-;若澄清石灰水无变化,则溶液中不含有CO32-。
B.向待测溶液中加入BaCl2溶液后有白色沉淀生成,滴入稀HCl后,沉淀消失且有气泡生
成,则溶液中含有CO32-。
三、化学肥料
农作物的生长需要N、P、K等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。
1、常用的肥料:
化学肥料:氨气(NH3·H2O)、碳酸氢铵(NH4HCO3)、硫酸钾(K2SO4)、磷矿粉[主要成分磷酸钙Ca3(PO4)2]、硫酸铵[(NH4)2SO4]、尿素[CO(NH2)2]、硝酸钾(KNO3)、磷酸二氢铵(NH4H2PO4)。
农家肥料:如厩肥、人粪尿、绿肥等。
2、各种肥料的功效(钾抗倒伏磷抗旱(寒),叶片发黄要用氮)
氮肥作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗); 缺氮:叶黄
钾肥作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆); 缺钾:叶尖发黄,易倒伏
磷肥作用:促进植物根系发达,穗粒增多,饱满(催果); 缺磷:生长迟缓,产量降低,根系不发达。
3、氮、磷、钾三种化肥的区别方法

4、铵态氮肥与碱混合加热,或者研磨,都有氨气放出:(反应实质:NH4+ + OH- = NH3↑ + H2O)
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑+ 2H2O;
2NH4NO3 + Ca(OH)2 = Ca(NO3)2 + 2NH3↑+2H2O;
氨气有刺激性气味,能使湿润的红色石蕊试纸变蓝,这些可用于铵态氮肥的检验。
NH4+的检验:加碱研磨,闻气味。
试剂:碱(NaOH、Ca(OH)2等)、湿润的红色石蕊试纸

酸碱盐的基础知识很多,很零碎,但是考试的题目综合性就比较强,所以知识点的串通是非常有必要的,有助于加深学习。

★单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+酸=盐+氢气(置换反应)
1.锌和稀硫酸:Zn+H 2SO4 = ZnSO4+H 2↑(实验室制取氢气,最常用)
(实验室制H2用的金属有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl,而Mg和Al反应太快,生成的氢气不易收集。)
(2)金属单质+盐(溶液)= 另一种金属+另一种盐
2.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu(古代的“湿法冶金”);
3.铝和硝酸银溶液反应:Al+3AgNO3 = Al(NO3)3 + 3Ag;
(3)碱性氧化物(金属氧化物)+酸 = 盐+水(属于复分解反应)
4.氧化铁和稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(硫酸除铁锈)
5.氧化钙和稀盐酸反应:CaO+2HCl = CaCl2 +H2O ;
(4)酸性氧化物(非金属氧化物) + 碱 = 盐+水(不是复分解反应)
6.苛性钠暴露在空气中变质:2NaOH+CO2 = Na2CO3 + H2O;
7.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+H2O;
(5)酸+碱=盐+水(中和反应) 基本反应类型:复分解反应
8.盐酸和烧碱反应:HCl + NaOH = NaCl + H2O;
9.盐酸和氢氧化钙反应:2HCl+Ca(OH)2=CaCl2+2H2O;
10.氢氧钠和硫酸反应:2NaOH + H2SO4=Na2SO4+2H2O;
(6)酸+盐=另一种酸+另一种盐
11.大理石与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑(实验室制CO2);
12.碳酸钠与稀盐酸反应:Na2CO3 +2HCl=2NaCl+H2O+CO2↑;
13.硫酸和氯化钡溶液反应:H2SO4+BaCl2=BaSO4↓+2HCl;
(7)碱+盐=另一种碱+另一种盐
14.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
15.硫酸铜溶液与氢氧化钡:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓;
(8)盐+盐 = 新盐 + 新盐
16.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO3
17.硫酸钠和氯化钡:Na2SO4+BaCl2 = BaSO4↓ + 2NaCl;
☞再次强调:
复分解反应必须生成沉淀,气体或水生成才能发生,且生成物的元素化合价不变。
写在最后:酸碱盐知识点零碎,但考试又很重要,涉及到的模块如物质的除杂,鉴别,提纯,离子共存,物质成分的探究等等,这些都需要把基本的知识点记忆,综合应用。化学的学习离不开化学方程式,反应的现象,物质的理化性质,物质的俗称、用途等等,这些都是需要记忆掌握的。凡是多下功夫,多总结,再加上题目的练习,初中化学还是很简单的。

加油!

