初中和高中化学实验,一直是困扰学生的难题,很多学生都是因为扣分,而无缘于重点学校。这也是很多家长看到我文章后面的微信号后,加我的原因。他们太像让孩子考上好的学校了。
以下内容涉及到 初高中常见物质的实验室制法,主要以基本教学内容中的各类物质的制取为主,辅以楼主认为需要掌握的物质实验室制法。接下来我将会把教科书上涉及制取的方法一一罗列,同时也会指出题目中出现常见问题。
下面是初中范围内的三种气体(氧气 氢气 二氧化碳)的实验室制法。正式介绍之前先介绍一下制取气体的装置。
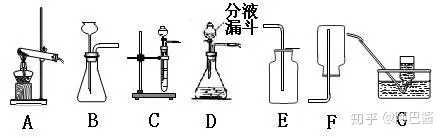
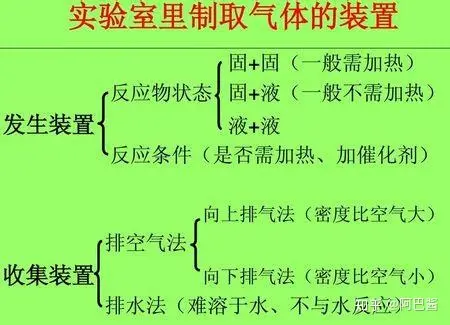
上图中 A为固固加热型 C为固液不加热型 B D既可以用作固液不加热也可以用作固液加热型
实验室的二氧化碳制法:
块状大理石(或石灰石)和稀盐酸反应。反应方程式为:CaCO3+2HCl==CaCl2+H2O+CO2↑
(注:该反应也是实验室制取氯化钙的方法)
反应装置:固固不加热型
气体中主要杂质:氯化氢气体以及水蒸气 除去方法:依次通过 饱和碳酸氢钠溶液 和 浓硫酸洗气 收集方法:向上排空气法或排饱和碳酸氢钠溶液法
改进方法:教科书中使用的是B装置,我们可以用上图的C或者D装置对其进行改进。(注:改进后能反应是否进行)
常见问题:
1.为什么用块状大理石(或石灰石)而不用纯净的碳酸钙固体? 答:相比较块状大理石(或石灰石)因其含有杂质而使反应比碳酸钙固体更快
2.为什么反应物要选择块状而非粉末状? 答:粉末状反应速率过快不利于二氧化碳的收集。(不选用浓盐酸亦同理)
实验室的氧气制法:
相对于双氧水制取氧气,考试时更注重氯酸钾和高锰酸钾加热分解制取氧气的操作。
(I.)双氧水在二氧化锰做催化剂下分解,反应方程式:
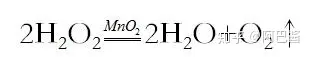
收集方法:向上排空气法或排水集气法
实验装置:固液不加热型。装置可以选用 B C D,但是C D更好
提纯:制取干燥的氧气流用浓硫酸(碱石灰、无水氯化钙等)进行洗气。【排水集气法就不用干燥了】
(II.)氯化钾在二氧化锰作催化剂加热条件下制取氧气。
化学方程式:
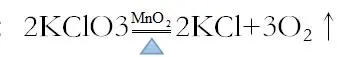
实验装置:固固加热型,上图的A装置
实验装置的气密性检查:将A装置装配好后,将导气管移入水中,微热试管。待试管恢复常温后,导气管中出现一段稳定的水柱则证明气密性完好。
实验装置的放置要求:试管口应微微向下(原因:氯酸钾药品可能受潮,加热时有水蒸气在试管中冷凝,若试管微微向上,冷凝的水会汇聚在试管底部从而使玻璃因温度骤变而爆裂)
(III.)加热高锰酸钾制取氧气
化学方程式:
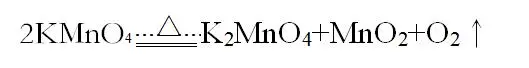
实验装置:固固加热型
检查气密性同(II.)
实验装置的放置要求:1、试管口应微微向下。2、试管口应该放一团棉花(防止反应过于剧烈使高锰酸钾进入导气管而堵塞导气管;对于排水集气法,还有就是防止高锰酸钾进入水溶液影响观察)
常见问题:
1、若实验室要用氯酸钾制取氧气而,恰好没有二氧化锰固体,则可以用什么什么药品代替二氧化锰? 答:高锰酸钾。原因:高锰酸钾加热分解出氧气和二氧化锰,生成的二氧化锰又催化氯酸钾分解)
2、在(II.)和(III.)实验完成后,如何回收催化剂二氧化锰。 答:向试管中加入足量水溶解后过滤并烘干滤渣
3、在题(2)中,玻璃棒的作用是什么,漏斗的放置有什么要求? 答:引流;漏斗下端应贴紧烧杯杯壁
【注】对于催化双氧水分解,我做到比较多的题目是比较 过氧化氢酶、二氧化锰和氯化铁 的催化效果强弱。结论为:催化效率 过氧化氢酶>二氧化锰>氯化铁
实验室的氢气制法
粗锌粒和稀硫酸反应
化学反应方式:Zn+H2SO4==ZnSO4+H2↑
实验装置:固液不加热型(上图装置的B C D, 当然是更推荐C D)
气密性检查:(见 氯化钾在二氧化锰作催化剂加热条件下制取氧气)
收集方法:排水集气法或向下排空气法
制取气体中所含杂质:水蒸气
除去方法:浓硫酸洗气
特殊要求:制取氢气时要先验纯
检验方法:先收集一小试管,再在空气中点燃,若出现淡蓝色火焰并听到轻微爆鸣声则证明氢气纯净(严格的说是较为纯净)
常见问题:
1、为什么实验室常使用粗锌粒而不适用纯锌、粉末状、或者铁 铝来制取氢气? 答:粗锌粒的反应速率适中,便于收集。
2、在上述反应发生时,可以采取什么方法使反应速率加快? 答:适当增加硫酸浓度;使用锌粉;在反应时滴入几滴硫酸铜(初中范围内不要求掌握,了解一下就可以了,原理在高中化学苏教版必修二中会提及:锌粒表面形成Zn—Cu原电池加快了反应的进行)
3、如果将稀硫酸换成稀盐酸,反应后的气体又该如何除杂? 答:通过足量碱石灰(CaO和NaOH的混合物)

