在初中阶段,我们会接触到化学这门学科,而对于大部分的孩子来讲,化学的学习与我们的数学学习是不相上下的,因为在化学学习中,需要我们记忆大量的化学方程式以及实验等这些,而且最主要是就算是记住了所有的知识点,如果不会运用也是不行的。
很多孩子也不是学不好化学,主要是不知道怎么去记忆我们的知识点,不知道哪些是重点,不知道哪些是我们考试中所要涉及到的,说白了,最重要的一点就是记不住,不会总结和归纳,所以导致在化学这块学习成绩不太理想。
因此,为了帮助孩子们解决这个问题,下面特意为大家总结了一份关于我们初中化学必考的一个知识点归纳与汇总,建议家有初中生的家长都可以收藏一份,以辅导孩子的化学学习之用。
一、身边的化学+化学实验
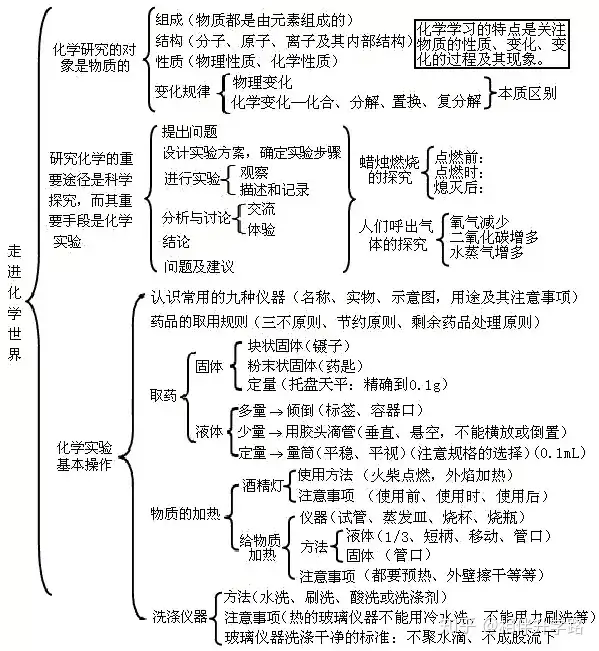
二、周围的空气
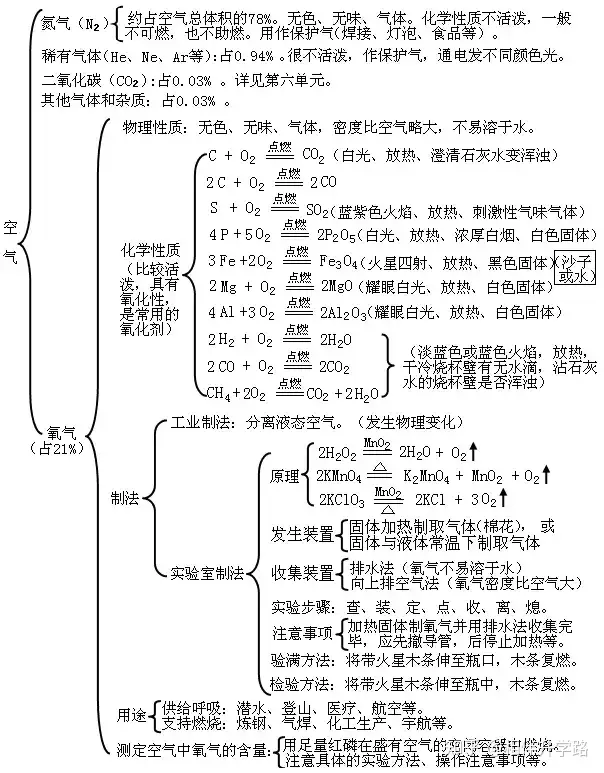
三、自然界的水

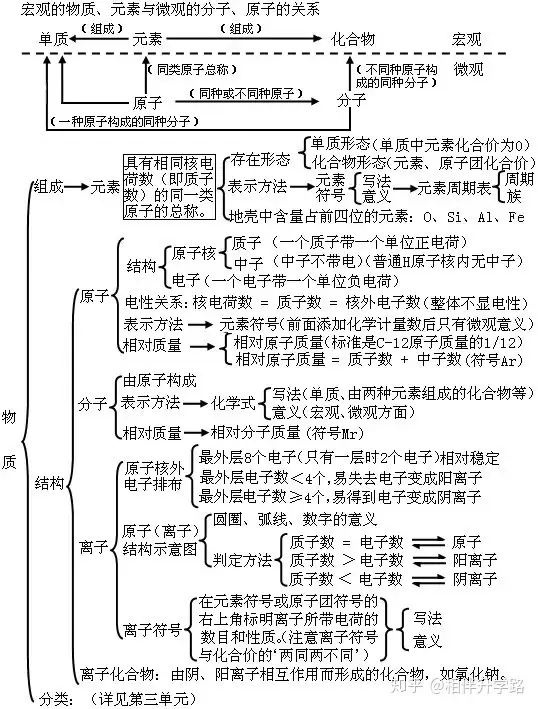
四、物质构成的奥秘
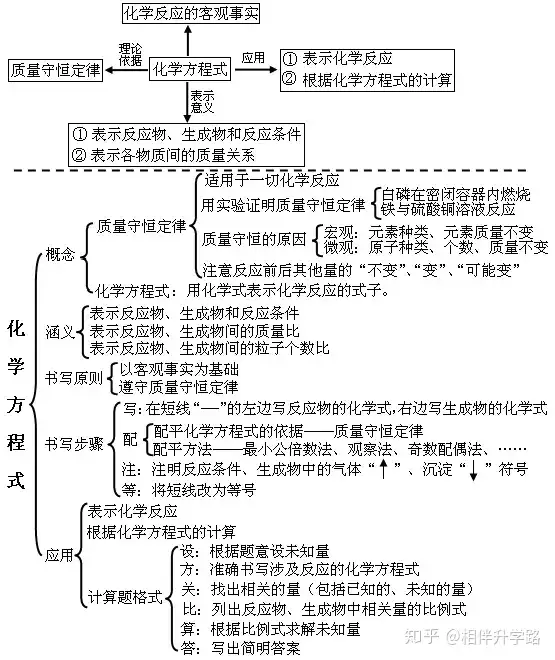
五、化学的方程式
六、碳和碳的化合物
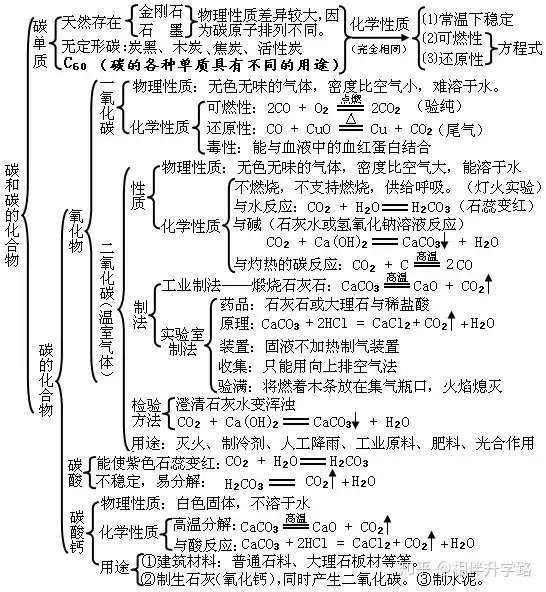
七、燃料及其利用
八、金属和金属材料

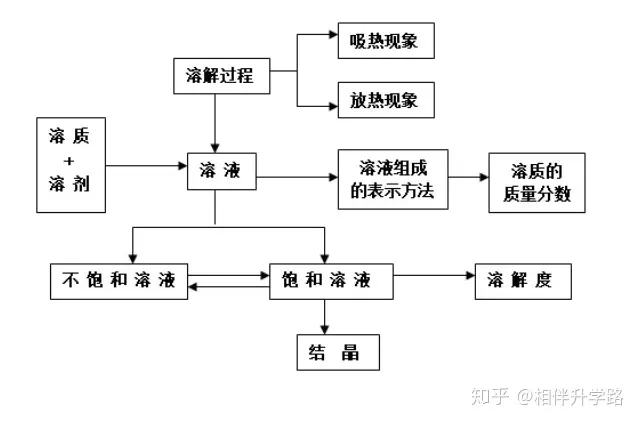
九、溶液
十、酸 碱 盐
1、化学用语
① 电离方程式:
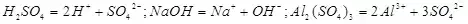
② 物质的俗称和主要成分:
生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3·H2O。
2、金属活动性
① 金属活动性顺序:
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au
② 金属活动性顺序的意义:
在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
③ 金属活动性顺序的应用: (1)排在氢前的金属能置换出酸里的氢(元素)。 (2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
3、酸、碱、盐的溶解性
① 常见盐与碱的溶解性:
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
② 八个常见的沉淀物:
氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁
③ 四微溶物:
Ca(OH)2(石灰水注明“澄清”的原因)
CaSO4(实验室制二氧化碳时不用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)
MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)
④ 三个不存在的物质:
氢氧化银、碳酸铝、碳酸铁
4、复分解反应发生的条件反应
有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)
① 不溶性碱只能与酸性发生中和反应;
② 不溶性盐,只有碳酸盐能与酸反应;
③ KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。
5、溶液的酸碱性与酸碱度的测定
① 指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝
无色的酚酞试液只遇碱溶液变红。注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
② pH值---溶液的酸碱度:pH<7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH>7溶液为碱性(越大碱性越强)
6、离子的检验
Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(在溶液中)---在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-
①(固体或溶液)---在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
②(在溶液中)---在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。【注】
① 在鉴别Cl-和SO42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显;
② 在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。
7、物质的颜色
①固体(多为白色)
黑色---CuO、C粉、MnO、2Fe3O4、
紫黑色---KMnO4
红色---Cu、Fe2O3红褐色---Fe(OH)3
蓝色---Cu(OH)2、CuSO4·5H2O绿色---Cu2(OH)2CO3
②溶液(多为无色)
浅绿色溶液---(亚铁盐溶液)FeCl2溶液、FeSO4;
黄色溶液--- (铁盐溶液)FeCl3溶液、Fe2(SO4)3 溶液、Fe(NO3)3;
溶液蓝色溶液---(铜盐溶液)CuCl2溶液、CuSO4溶液、Cu(NO3)2;
溶液蓝绿色溶液---CuCl2溶液(较浓)。8、酸、碱、盐的特性
① 浓盐酸---有挥发性、有刺激性气味、在空气中能形成酸雾。
②浓硝酸---有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
③浓硫酸---无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放出大量的热。有强氧化性。
④氢氧化钙---白色粉末、微溶于水。
⑤氢氧化钠---白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。
⑥硫酸铜---白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4·5H2O)。
⑦碳酸钠---白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3·10H2O)。
⑧氨水(NH3·H2O)---属于碱的溶液。
9、酸与碱的通性和盐的性质
1. 酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色;
(2)酸能与活泼金属反应生成盐和氢气;
(3)酸能与碱性氧化物反应生成盐和水;
(4)酸能与碱反应生成盐和水;
(5)酸能与某些盐反应生成新的盐和新的酸。2. 碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色;
(2)碱能与酸性氧化物反应生成盐和水;
(3)碱能与酸反应生成盐和水;
(4)某些碱能与某些盐反应生成新的盐和新的碱。3. 盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属;
(2)某些盐能与酸反应生成新的盐和新的酸;
(3)某些盐能与某些碱反应生成新的盐和新的碱。每天更新好的教育理念,全面的学习资料、高效的学习方法,因为有您的关注,才会让我们更加努力!想要word文档资料的私聊!
求学之路,任重道远,让我们携手并进,一起努力!

